Ximena @Ximenita hace 11 meses me encantaa, hasta se me hizo más fácil
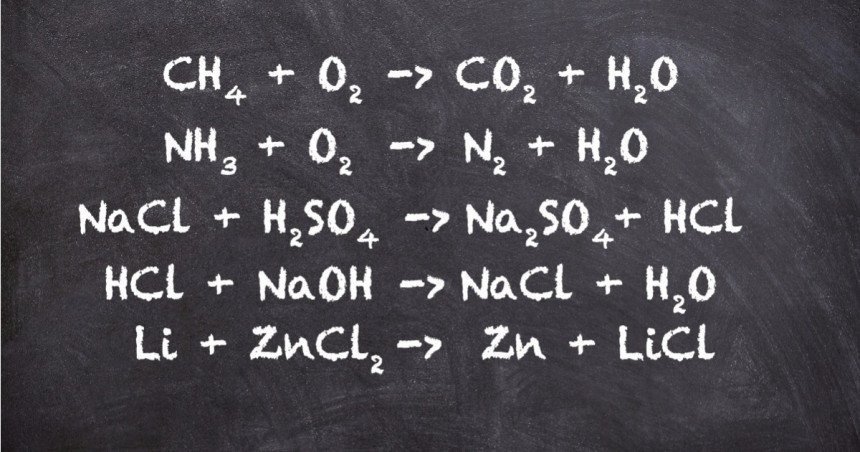
El balanceo de ecuaciones químicas es un proceso fundamental en la química, ya que permite representar correctamente las reacciones químicas, asegurando que se cumpla la Ley de la Conservación de la Materia (Antoine Lavoisier). Esto significa que la cantidad de átomos de cada elemento debe ser igual en los reactivos y en los productos. Una de las técnicas más sencillas y utilizadas para balancear ecuaciones es el método de tanteo. En esta publicación, aprenderás qué es, cómo funciona y cómo aplicarlo paso a paso.
🔬 ¿Qué es el método de tanteo? El método de tanteo, también llamado método de inspección, consiste en ajustar los coeficientes estequiométricos (números que se colocan antes de cada compuesto en la ecuación química) mediante prueba y error, hasta que haya el mismo número de átomos de cada elemento en ambos lados de la ecuación. Es un proceso manual, pero muy intuitivo, ideal para ecuaciones sencillas.
🧪 Pasos para balancear una ecuación por tanteo
Vamos a aplicar el método con un ejemplo práctico:
🔹 Ejemplo: Reacción de combustión del metano
CH₄+O₂ → CO₂+H₂O
1️⃣ Identificar los elementos presentes
En esta ecuación tenemos carbono (C), hidrógeno (H) y oxígeno (O).
2️⃣ Balancear el elemento que aparece una sola vez en cada lado
El carbono (C) solo está en el CH₄ y en el CO₂. Como hay 1 átomo de C en CH₄ y 1 en CO₂, ya está balanceado.
3️⃣ Balancear el hidrógeno (H)
En los reactivos, el metano (CH₄) tiene 4 átomos de hidrógeno.
En los productos, el agua (H₂O) tiene 2 átomos de hidrógeno por molécula.
Para igualarlos, colocamos un coeficiente 2 delante del H₂O:
CH₄+O₂ → CO₂+2H₂O
Ahora hay 4 átomos de hidrógeno en ambos lados. ✅
4️⃣ Balancear el oxígeno (O)
En los productos, hay:
En los reactivos, el oxígeno proviene del O₂, que tiene 2 átomos por molécula. Para obtener 4 átomos, colocamos un coeficiente 2 delante del O₂:
CH₄+2O₂ → CO₂+2H₂O
5️⃣ Verificar que la ecuación está balanceada
🎉 ¡Ecuación balanceada!
🔥 Ejercicios propuestos
¡Pon a prueba lo aprendido! Intenta balancear estas ecuaciones usando el método de tanteo:
1️⃣ Reacción de combustión del etanol:
C₂H₅OH+O₂→CO₂+H₂O
2️⃣ Reacción de formación del agua:
H₂+O₂→H₂O
3️⃣ Reacción de síntesis del amoníaco:
N₂+H₂→NH₃
Déjanos tu respuesta en los comentarios o compártenos tus dudas. ¡Sigue aprendiendo con Diario Politécnico! 🚀

De un proyecto aula del CECyT 4 a una plataforma nacional de bienestar